
Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Sedangkan untuk perbedaan asam dan basa dari segi pengertian, ditinjau dari pengertian basa adalah zat kimia yang menerima ion atau proton hidrogen. Untuk basa ini sendiri akan menyumbangkan elektron, dimana keterbalikan dari asam. Hal tersebut terlihat dari peran basa di dalam air, dimana zat kimia ini akan mengurangi konsentrasi ion hidronium.
PPT ASAM BASA PowerPoint Presentation, free download ID5640840
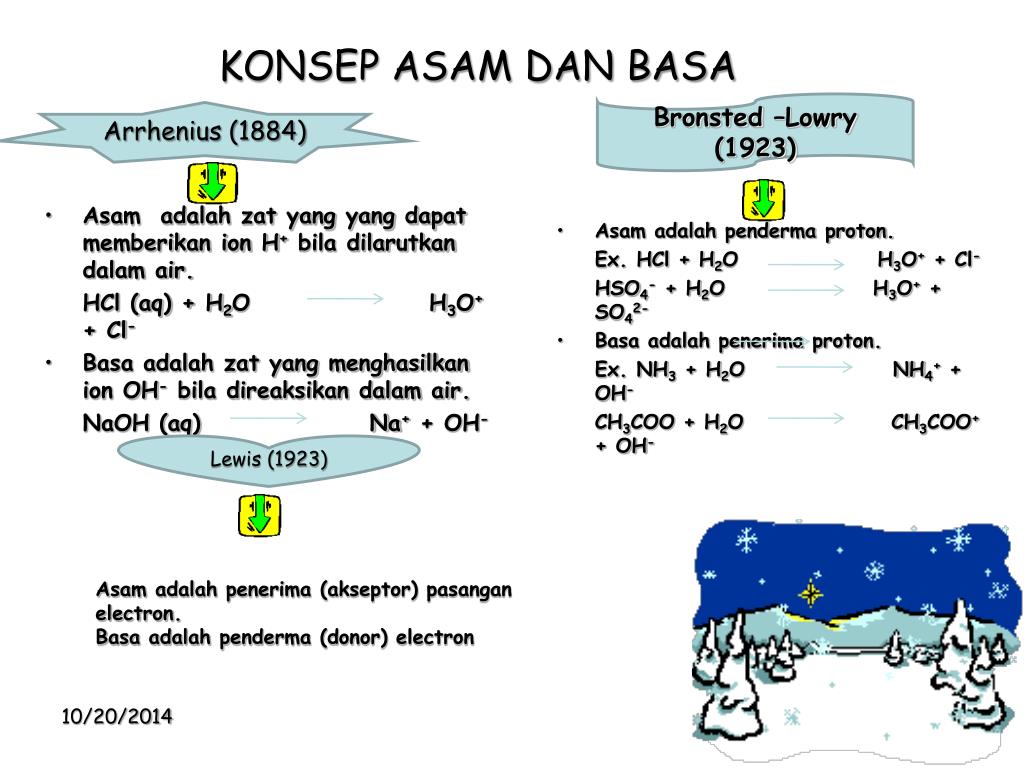
Pengertian Asam Basa. 1. Asam. Asam adalah senyawa kimia yang apabila dilarutkan didalam air, maka akan menghasilkan larutan dengan pH lebih kecil dari 7. Asam adalah sebuah zat yang bisa memberi proton (ion H+) terhadap zat lain (basa), atau bisa menerima pasangan elektron bebas dari sebuah basa.
Indikator Asam Basa
Pengertian Asam, Basa, Dan Garam. Pengertian Asam, Basa, Garam, Ciri, Sifat, Indikator, Gambar dan Contoh : Asam adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Basa adalah senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Asam Basa - Pengertian, Teori, Derajat Keasaman (PH) dan Reaksinya - Materi yang sangat kompleks dan menjadi dasar saat siswa belajar pada kelas 11 SMA Semester 2. Jadi usahakan jangan sampai kamu tertinggal ataupun tidak paham materi asam basa karena sangat sulit untuk mengerti pada materi berikutnya.

Pengertian Asam Basa, Teori, Jenis Penggolongan dan Contohnya Ilmu Kimia
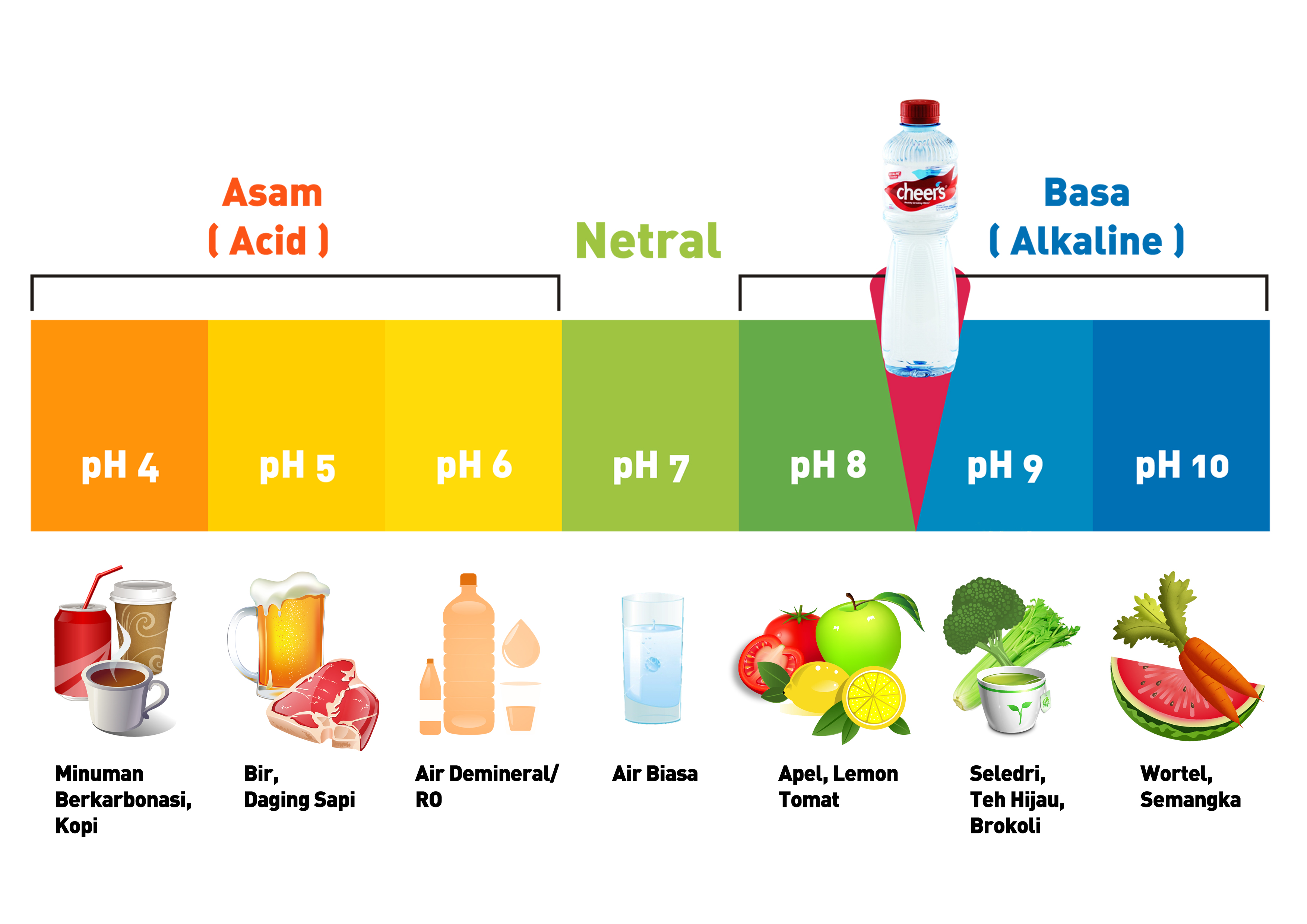
Kadar asam atau basa suatu zat dapat diuji dengan kertas lakmus. Rumusnya seperti ini: - Asam: lakmus merah tetap merah, lakmus biru menjadi merah. - Basa: lakmus biru menjadi biru, lakmus merah jadi biru. Contoh benda yang bersifat basa: soda kue, deterjen bubuk, pasta gigi, tablet obat magh, sabun mandi, dan lainnya.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
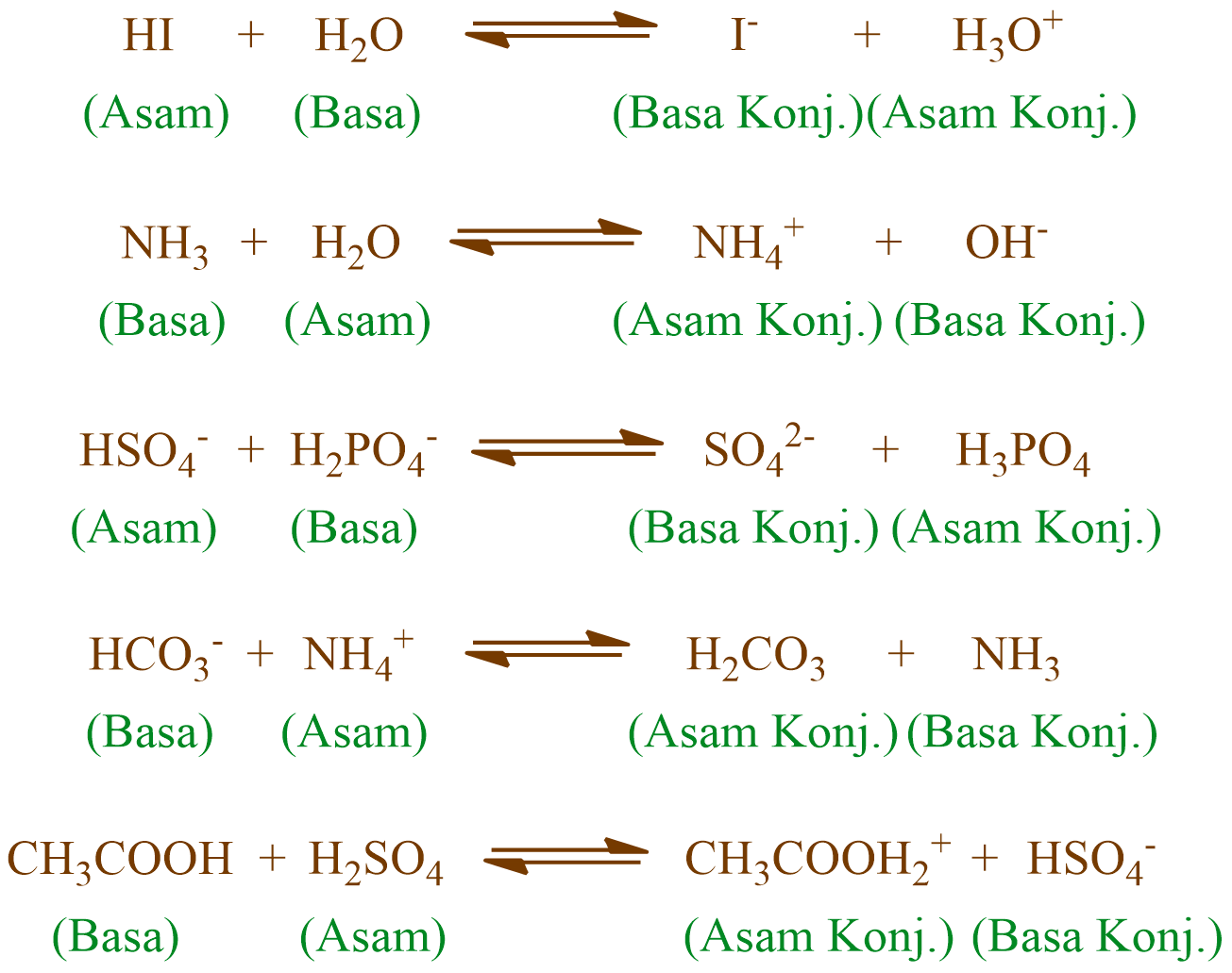
Perbedaan kedua zat tersebut dapat dilihat dari zat atau ion yang dihasilkan. 2. Asam Basa Menurut Bronsted-Lowry Lebih dikembangkan lagi, proses pengidentifikasian asam dan basa dilakukan dengan banyak jenis larutan. Terlepas dari larutannya, asam dijelaskan punya tugas sebagai zat penghasil ion proton H+ (pendonor proton) sedangkan basa.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Perbedaan Antara Asam dan Basa. Berikut ini adalah poin penting yang membedakan asam dengan asam basa: Menurut konsep Arrhenius: Asam adalah zat ketika dilarutkan dalam air, meningkatkan konsentrasi ion H +, sedangkan basa adalah zat ketika dilarutkan dalam air, meningkatkan konsentrasi ion OH-..

Buatlah tabel perbedaan asam, basa dan garam
Dari penjabaran asam dan basa, kedua bahan kimia tersebut memiliki beberapa perbedaan. Asam dan basa dapat dibedakan dari beberapa hal di bawah ini: Rasa; Larutan asam dan basa yang jauh berbeda. Seperti namanya, asam cenderung terasa asam. Sementara basa cenderung terasa pahit. Jadi saat dirasakan, perbedaannya langsung terasa dan kita tidak.

Perbedaan ASAM DAN BASA PERBEDAAN ASAM DAN BASA No. Karakteristik Asam Basa 1 Rasa Masam Pahit
Perbedaan Larutan Asam dan Basa. Setelah menyimak penjelasan di atas, dapat disimpulkan bahwa Perbedaan Larutan Asam dan Basa seacara umum yaitu: Basa merupakan senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air yang beranggotakan unsur/senyawa kimia yang memiliki pH lebih dari 7. Sedangkan Asam merupakan senyawa kimia yang.

Contoh zat asam dan basa 2021
Asam dan Basa: Pengertian, Fungsi, Ciri-ciri, hingga Contohnya. by Ahmad Nurhakim & Andjar Tyassih, S.Si. Februari 16, 2023. Dalam kehidupan sehari-hari, kita banyak menjumpai asam dan basa, mulai dari makanan hingga barang yang digunakan untuk menunjang aktivitas harian. Selain itu, istilah asam dan basa pun bukanlah istilah baru, sudah.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Asam + basa → garam + air. HCl + KOH → KCl + H2O. Garam dapur (NaCl) diperoleh dari air laut yang mengalami penguapan dan kristalisasi. Untuk menjadikannya garam beryodium, harus diproses iodisasi (garam kalium/KI). Sifat-sifat atau ciri-ciri garam: Larut dalam air. Contohnya : KNO3, NH4Cl, Na2SO4. Sukar larut dalam air.

(DOC) Perbedaan asam dan basa Tina Tina Academia.edu
Perbedaan asam dan basa juga dapat kita lihat dari hasil reaksi keduanya dengan air. Bila senyawa asam dilarutkan ke dalam air, maka akan terjadi ionisasi yang menghasilkan ion H+, sementara bila senyawa basa dilarutkan ke dalam air, maka ion yang terbentuk adalah ion OH-. Nah, itulah beberapa perbedaan asam dan basa dalam tabel yang bisa kami.

Pengertian Asam dan Basa Serta Penggunaannya
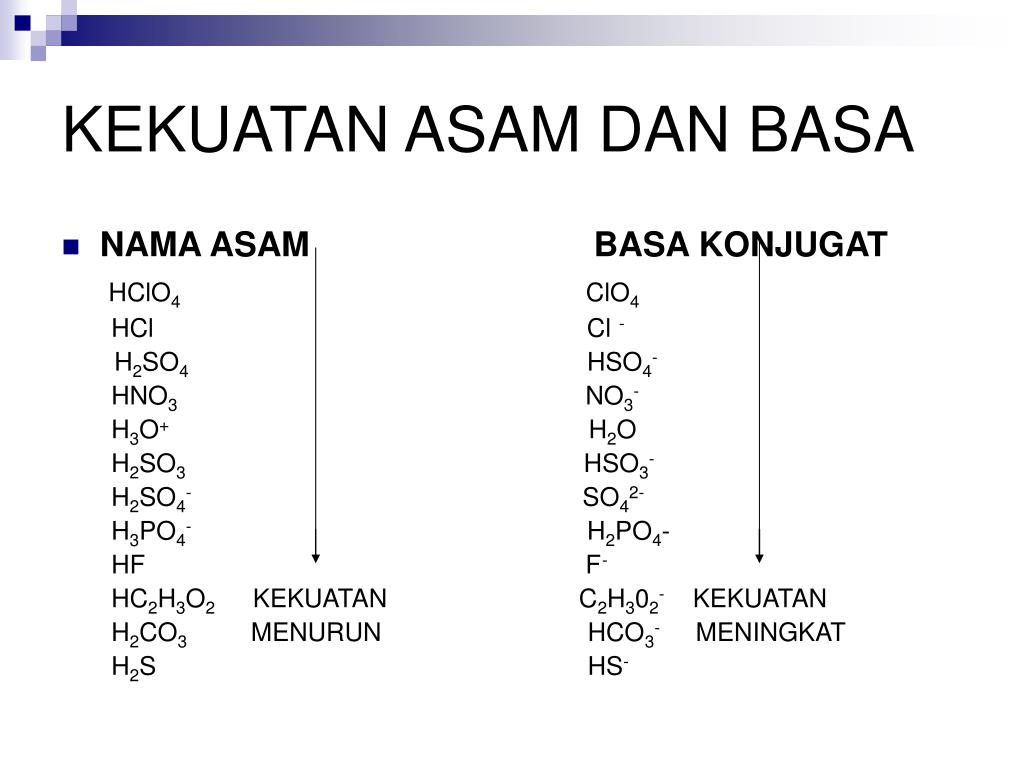
Adapun asam krlorida adalah yang mendonorkan proton karena melepaskan proton dan berubah menjadi muatan negatif. Sehingga asam krlorida (HCl) adalah asam dan ion klorida (CL-) adalah basa konjugasinya. Adapun perbedaan asam lemah dan kuat pada teori asam basa Bronsted-Lowry dapat dilihat dari tingkat disosiasi zat dalam laruan.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Perbedaan Asam dan Basa. Perbedaan sifat dan ciri antara zat asam dan basa bisa dikatakan sangat mencolok. Perbedaan tersebut misalnya terletak pada rasa, kemampuannya dalam merubah kertas lakmus, reaksinya jika dilarutkan dalam air, serta dari sifatnya. Secara lengkap, perbedaan asam dan basa disajikan pada tabel berikut! Perbedaan. Asam.

Mengenal Asam Basa Sifat Cara Membedakan Dan Klasifikasinya Kimia Riset
Teori-teori Asam Basa Menurut Para Ahli. Para ahli mengemukakan pendapatnya mengenai teori asam basa. Setiap ahli memiliki pandangan yang berbeda, sehingga menciptakan teori-teori asam basa. Berikut beberapa teori asam basa menurut para ahli. Kimia Dasar 2 Ed 3: Raymond Chang. 1.

Perbedaan Antara Asam & Basa Dengan Ciri Cirinya Kertas Lakmus UCUN IPA SMP 2019 no 21 BELATIK
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.