
Tugas Kimia Dasar Asam Basa Konjugasi UR Studocu
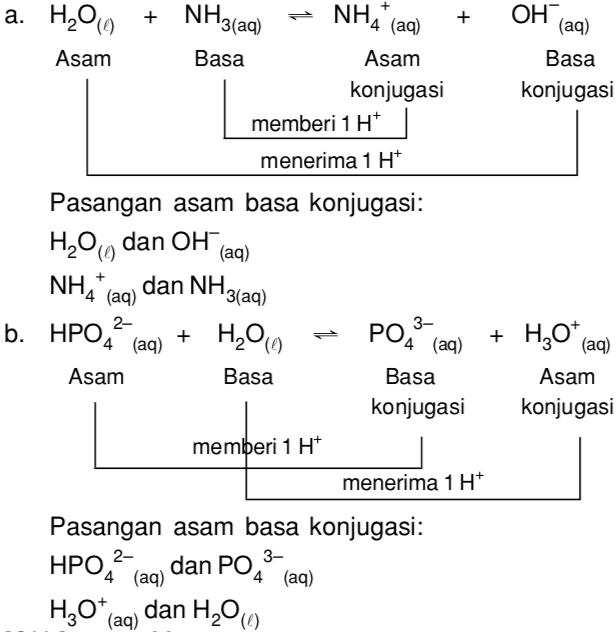
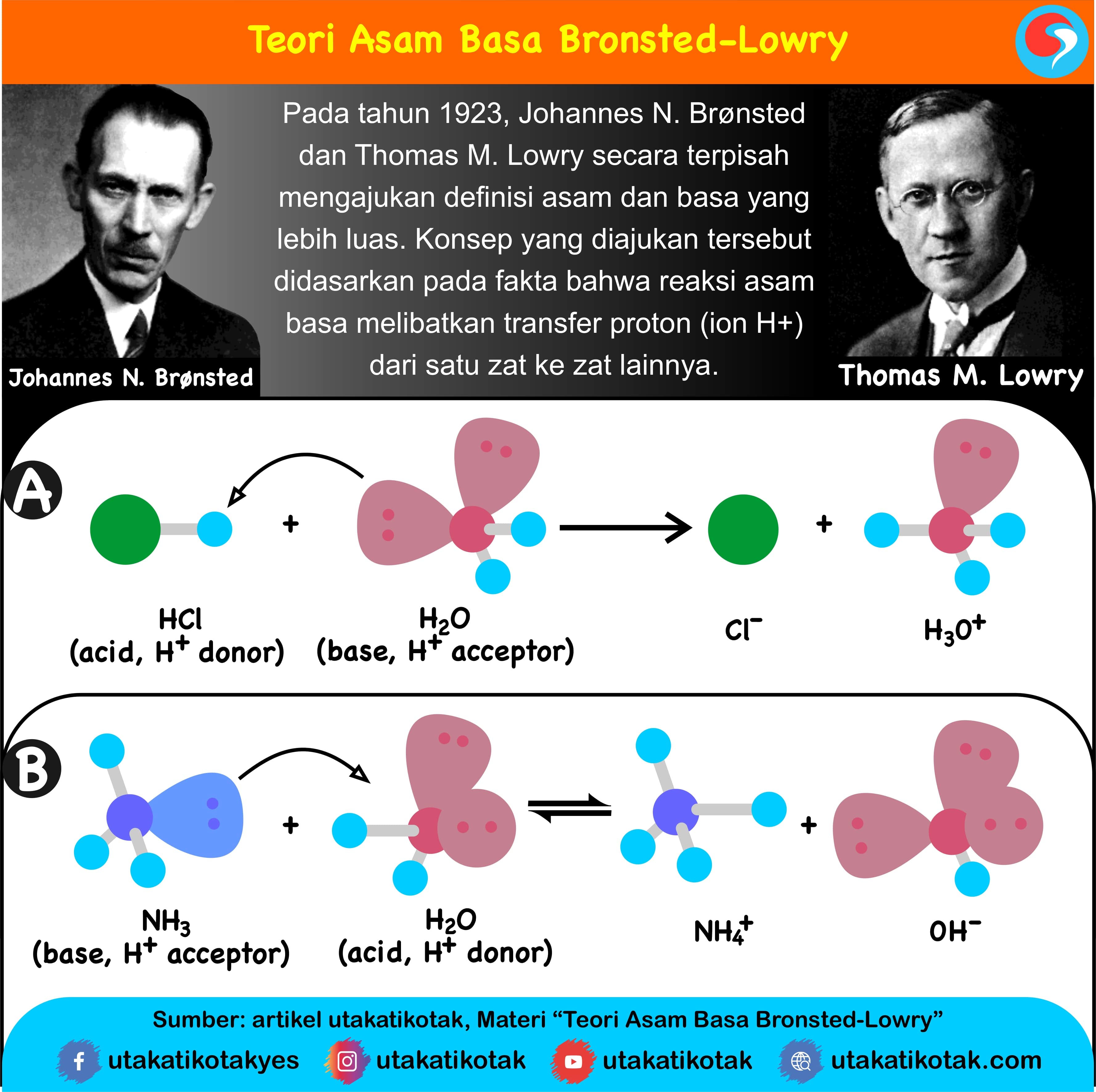
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

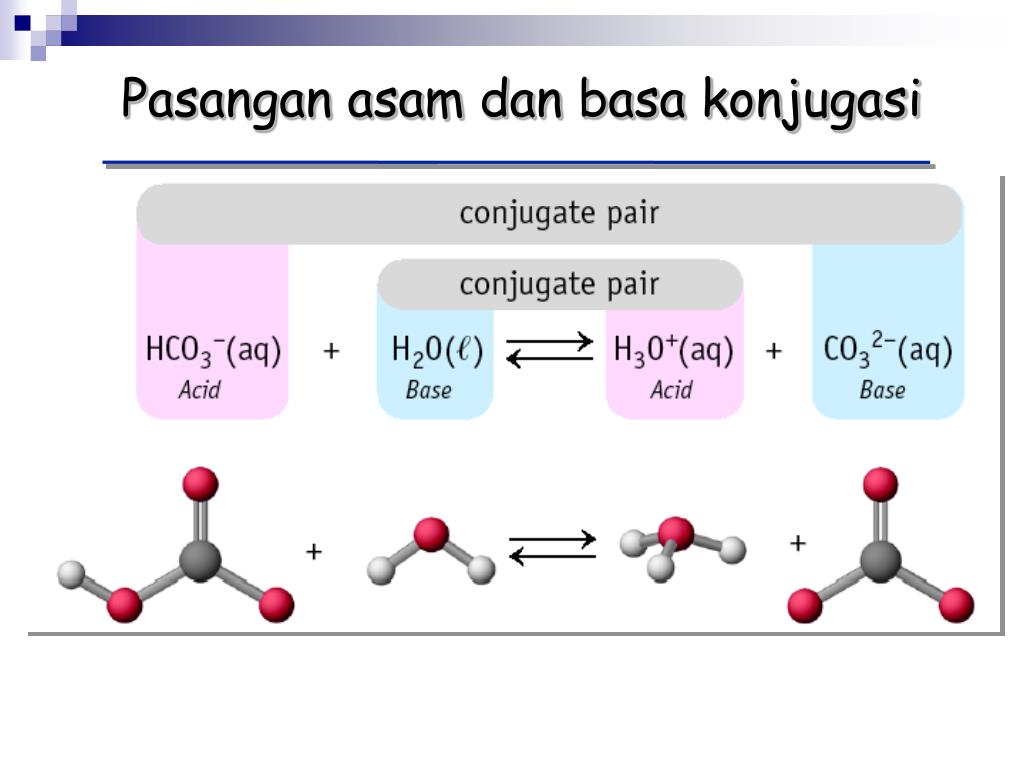
Pasangan asambasa konjugasi dari reaksi NH3(aq)+H2O(l)
Contoh Basa Konjugasi. Reaksi kimia umum antara asam konjugasi dan basa konjugasi adalah: HX + H 2 O X + H 3 O +. Dalam reaksi asam-basa, Anda dapat mengenali basa konjugasi karena merupakan anion. Untuk asam klorida (HCl), reaksi ini menjadi: HCl + H 2 O Cl + H 3 O +. Di sini, anion klorida, Cl , adalah basa konjugasi.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Bronsted Lowry juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang memperoleh ion hidrogen, sedangkan basa konjugasi adalah yang tersisa setelah asam memberikan proton dalam sebuah reaksi kimia.. Berikut ini contoh asam dan basa yang ada di sekitarmu: Asam. Jeruk yang mengandung C 6 H 8 O 7. Cuka yang mengandung CH 3.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Asam lemah: HA + H 2 O ⇌ H 3 O + + A - (basa kuat) Basa sesaat setelah menerima proton akan berubah menjadi asam konjugasi dari basa tersebut. Contoh tipe reaksi: Basa kuat: B + H + → BH + (asam lemah) Bila ditulis secara lengkap: Basa kuat: B + H 3 O + → BH + (asam lemah) + H 2 O. Basa lemah: B + H + ⇌ BH + (asam kuat) Bila ditulis.

Asam basa konjugasi kimia SMA YouTube
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.
Asam Dan Basa Konjugasi Dengan Contoh Soal Rumus Kimia Riset
1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa Brønsted-Lowry . Perhatikan persamaan pelarutan asam nitrat dalam air berikut.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.

Asam basa konjugasi soal kimia SMA YouTube
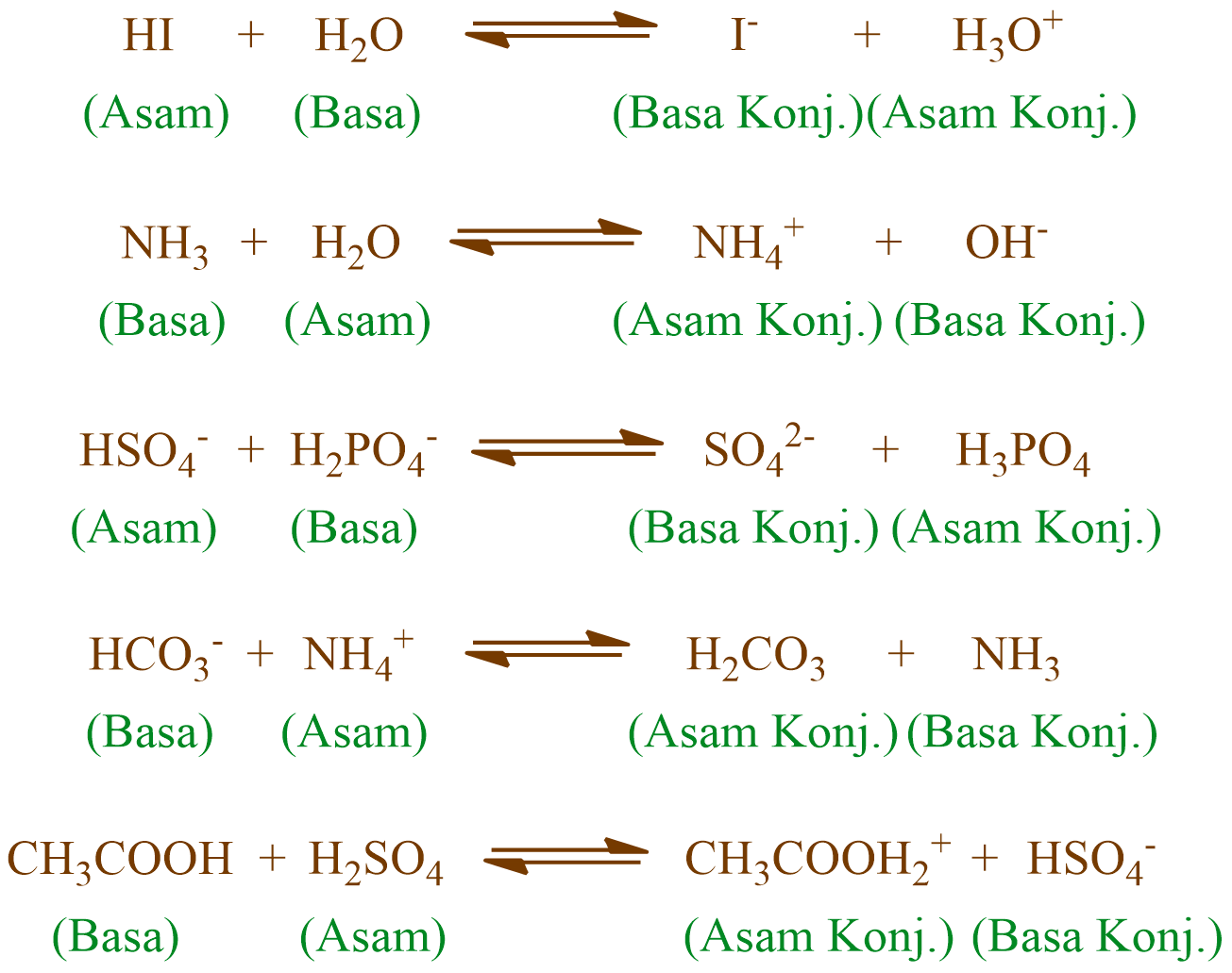
Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry! Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya. Artinya, asam melepaskan proton (H+) untuk mencapai kesetimbangan reaksi dan berubah menjadi basa.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Teori asam basa Bronsted Lowry menjelaskan rumus kimia dari pasangan asam basa konjugasi dan hanya berbeda satu proton H+ saja. Reaksi di bawah HCl merupakan asam karena telah memberikan proton serta NH3 serta merupakan basa karena menerima proton. Sementara ion Cl- adalah basa konjugasi dari HCl dan NH4+ adalah asam konjugat dari NH3.

Teori Asam Basa
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Mana yang berfungsi sebagai asam, basa, asam konjugasi, d...
Asam dan Basa Konjugasi - RumusKimia.net berikut akan berbagi penjelasan tentang Asam dan Basa Konjugasi. Untuk pengertian Asam dan Basa Konjugasi.. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Cara mudah menentukan pasangan dari asam basa konjugasi dari reaksi kimia. Kimia sma.

Teori Asam Basa
Sedangkan, jika pH larutan lebih besar dari 7, maka larutan tersebut bersifat basa. Contoh Penerapan Rumus Asam Konjugasi. Untuk memahami lebih jelas tentang rumus asam konjugasi, berikut ini adalah contoh penerapannya: Diberikan asam klorida (HCl) dan basa amonia (NH3). Hitunglah rumus asam konjugasi dari masing-masing zat.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Jika basa konjugat lebih stabil dari asam, maka asam akan cenderung berdisosiasi dan menjadi lebih kuat, sedangkan jika sebaliknya maka akan menjadi asam lemah. Contoh asam:pasangan basa konjugasi. Berikut adalah beberapa contoh tambahan dari berbagai asam dan basa konjugatnya masing-masing: Asam klorida dan anion klorida (HCl dan Cl -)

Asam dan Basa Konjugasi
Berdasarkan teori asam basa Bronsted-Lowry, jika dalam suatu reaksi asam dan basa, apabila asam mendonorkan protonnya, maka akan dihasilkan spesies basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan spesies asam konjugasi. Nah, itulah yang dimaksud dengan pasangan asam dan basa konjugasi. Untuk lebih mudahnya, perhatikan 23 pasangan asam dan basa konjugasi berikut: No. Asam